- Em Beneficio da vida
São compostos que doam íons OH - em soluções aquosas. O papel da água é essencial nesta definição.Pure sólidos como NaOH deve ser dissolvido em água para atuar como uma base. Há muitas bases diferentes, mas eles tem algo em comum. Todos eles têm um íon hidróxido, OH 1 - e um metal.
Bases mais comuns na vida cotidiana são:
• Hidróxido de sódio ou soda cáustica (NaOH)
o É a base mais importante da indústria e do laboratório. É fabricado e consumido em grandes quantidades.
o É usado na fabricação do sabão e glicerina:
(óleos e gorduras) + NaOH glicerina + sabão
o É usado na fabricação de sais de sódio em geral. Exemplo: salitre.
HNO3 + NaOH NaNO3 + H2O
o É usado em inúmeros processos industriais na petroquímica e na fabricação de papel, celulose, corantes, etc.
o É usado na limpeza doméstica. É muito corrosivo e exige muito cuidado ao ser manuseado.
o É fabricado por eletrólise de solução aquosa de sal de cozinha. Na eletrólise, além do NaOH, obtêm-se o H2 e o Cl2, que têm grandes aplicações industriais.

• Hidróxido de cálcio (Ca(OH)2)
o É a cal hidratada ou cal extinta ou cal apagada.
o É obtida pela reação da cal viva ou cal virgem com a água. É o que fazem os pedreiros ao preparar a argamassa:
o É consumido em grandes quantidades nas pinturas a cal (caiação) e no preparo da argamassa usada na alvenaria.
• Amônia (NH3) e hidróxido de amônio (NH4OH)
o Hidróxido de amônio é a solução aquosa do gás amônia. Esta solução é também chamada de amoníaco.
o A amônia é um gás incolor de cheiro forte e muito irritante.
o A amônia é fabricada em enormes quantidades na indústria. Sua principal aplicação é a fabricação de ácido nítrico.
o É também usada na fabricação de sais de amônio, muito usados como fertilizantes na agricultura. Exemplos: NH4NO3, (NH4)2SO4, (NH4)3PO4
o A amônia é usada na fabricação de produtos de limpeza doméstica, como Ajax, Fúria, etc.
• Hidróxido de magnésio (Mg(OH)2)
o É pouco solúvel na água. A suspensão aquosa de Mg(OH)2 é o leite de magnésia, usado como antiácido estomacal. O Mg(OH)2neutraliza o excesso de HCl no suco gástrico.
Mg(OH)2 + 2HCl MgCl2 + 2H2O
• Hidróxido de alumínio (Al(OH)3)
o É muito usado em medicamentos antiácidos estomacais, como Maalox, Pepsamar, etc.
o Anexos:
• Hidróxido de sódio.
• Hidróxido de Cálcio.
Grupo : Bruno Araujo, Dandara Vidal, Douglas, Larissa Souza, Lorena Freire, Renata Jatobá.
- E a poluição
Só para esclarecer: alcalino é o mesmo que básico.
Introdução
Definindo:
Bases são substâncias que, em solução aquosa, sofrem dissociação liberando o ânion OH-.
Existem bases fortes e bases fracas, são bases fortes as bases que se ionizam quase completamente, em solução aquosa, nos seus iões (incluindo, portanto, os iões OH-); são bases fracas aquelas cuja ionização, também em solução aquosa, seja bastante restrita
- Mas a presença da base na nossa vida cotidiana é bem mais ampla do que se imagina.
Uma das características das bases é seu sabor adstringente, que “amarra” a boca, ou seja, diminui a salivação e também por ser algo escorregadio ao tacto.
Da mesma forma que os ácidos, as bases também conduzem corrente elétrica quando dissolvidas em água.
Ele também é usado em alimentos, remédios, produtos de higiene ou cosméticos. É ainda matéria prima indispensável em um vasto universo de aplicações industriais. Quando utilizamos um produto para desentupir canalizações estamos perante uma base. Mesmo um adubo, que é utilizado numa plantação como fonte de azoto para as plantas, é um composto que resultou de uma reação com uma base, o amoníaco.
°CURIOSIDADE:
O tomate possui acidez ou alcalinidade? Se alguém te perguntasse você saberia responder? Muita gente acha que é ácido por possuir um “azedinho”, mas é alcalino e sua ingestão auxilia a controlar o equilíbrio ácido-básico em nosso corpo.
Essa mesma função é realizada por outros alimentos básicos, como: leite, legumes e frutas, creme de leite, água natural, temperos (orégano, salsinha, coentro, entre outros).
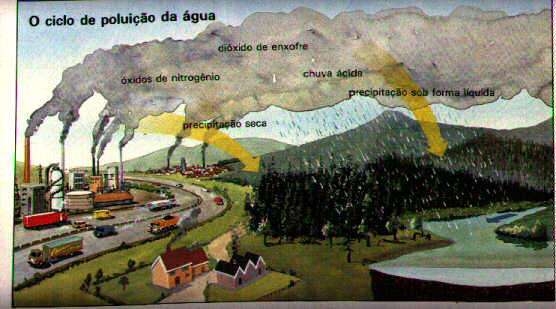
POLUIÇÃO
O ser humano consome em média 12.000 litros de ar por dia. O ar sofre modificações na sua composição conforme: o local (rural, urbano) que se vive, onde se trabalha (interior ou exterior) avaliação da atividade cotidiana, se submete a riscos respiratórios ou não, se é fumante ou não, entre outros. A origem mais frequentes destas modificações está na atividade humana que causam consequências sobre o meio ambiente. O poluente é substância nociva que em dose elevada leva a consequências desastrosas ao ambiente (animal e vegetal) e a nosso organismo.
TABELA

SOLUÇÃO:
Explica o deputado estadual Miguel Sena que o projeto se fundamenta na regulamentação e fomento da reposição florestal aos diversos setores consumidores, bem como a regulamentação da comercialização de créditos de reposição florestal, como modalidade de fomento a plantios florestais, através da elaboração e execução de projetos de florestamento, reflorestamento, levantamento circunstanciado, projetos de implantação e manutenção de florestas exóticas e nativas existentes em território do Estado de Rondônia, mediante a obrigatoriedade da recomposição do volume explorado, através do plantio de espécies florestais adequadas e da compensação florestal em relação às emissões de bases poluentes a base de carbono sob a forma de CO2.
Ao defender a aprovação do projeto, o deputado Miguel Sena destacou que as vantagens econômicas são inúmeras, dentre as quais se destacam: geração de empregos diretos e indiretos no campo; aumento do Produto Interno Bruto; e a sustentabilidade do setor madeireiro. Salientou ainda as vantagens sociais, tais como: geração de renda aos produtores rurais; fixação do homem no campo; além da diversificação das atividades no campo.

GRUPO: Catarina Borges, Marilia Mutti, Marjory Uzeda, Lisa Sales, Paula Castro e Rauan.
REFERÊNCIAS BIBLIOGRAFICAS
• http://www.mundoeducacao.com.br/quimica/bases-no-cotidiano.htm
• http://www.e-escola.pt/topico.asp?hid=382
• http://educacao.uol.com.br/quimica/ult1707u8.jhtm
• http://www.brasilescola.com/quimica/bases.htm
• http://www.ale.ro.gov.br/noticias/projeto-regulamenta-reposicao-florestal-no-estado-de-rondonia/
• http://www.ionsplus.com.br/poluentes.html