- Em benefício da vida
Dióxido de carbono (CO2):
O Dióxido de Carbono é o que nós conhecemos como gás carbônico, O CO2 é um dos gases do efeito estufa que menos contribui para o aquecimento global, já que representa apenas 0,03% da atmosfera.
É encontrado em refrigerantes e águas gaseificadas, ele reage com a água fazendo com que o meio fique ácido, daí o porquê dos refrigerantes serem ácidos.
É um gás incolor, inodoro, mais denso que o ar. Não é combustível e nem comburente, por isso, é usado como extintor de incêndio.
O dióxido de carbono é essencial à vida no planeta. Visto que é um dos compostos essenciais para a realização da fotossíntese - processo pelo qual os organismos fotossintetizantes transformam a energia solar em energia química.

- Peróxido de hidrogênio (H2O2):
É um líquido incolor que pode explodir violentamente se for aquecido e, justamente por isso, é utilizado na projeção de foguetes. Este composto também é conhecido como “água oxigenada”, aquela usada para clarear pêlos e cabelos. A solução aquosa concentrada a 3 % de peróxido de hidrogênio é vendida em farmácias para uso anti-séptico e alvejante. Soluções com concentração superior a 30 % são utilizadas na indústria como alvejante de madeira e fibras têxteis e na propulsão de foguetes.

Óxido de Cálcio (CaO):
O óxido de Cálcio não é encontrado na natureza no estado puro, ou seja, nós apenas encontraremos o Oxido de Cálcio através da decomposição térmica de calcário (de 825[1] a 900 °C) esta chamada de Calcinação. O Oxido de Cálcio é mais conhecido como cal viva ou cal virgem, é um composto sólido branco. Normalmente utilizada na indústria da construção civil para elaboração das argamassas com que se erguem as paredes e muros e também na pintura, a cal também tem emprego na indústria cerâmica, siderúrgicas (obtenção do ferro) e farmacêutica como agente branqueador ou desodorizador. O óxido de cálcio também é usado para produzir hidróxido de cálcio, na agricultura para o controle de acidez dos solos, e na metalurgia extrativa para produzir escória contendo as impurezas (especialmente areia) presentes nos minérios de metais.
- Óxido Nitroso (N2O):
É utilizado como anestésico, também é conhecido como protóxido de nitrogênio se apresenta na forma de um gás incolor, composta de duas partes de nitrogênio e uma de oxigênio, cuja formula química é N2O e sua formula estrutural é N--N—O. Administrado juntamente com o Oxigênio, possui efeito analgésico e sedativo. O Óxido Nitroso também é utilizado para melhorar a desempenho dos motores.
Dióxido de Enxofre (SO2):
O Dióxido de Enxofre é um gás incolor tóxico de cheiro forte e altamente irritante não inflamável. É usado para a obtenção de ácido sulfúrico e no branqueamento de óleos alimentícios, entre outras aplicações.O dióxido de enxofre é muito solúvel em água. É produzido naturalmente pelos vulcões e em certos processos industriais. Na indústria, o dióxido de enxofre serve sobretudo para a produção de ácido sulfúrico, que possui numerosas aplicações como produto químico. O dióxido de enxofre é ainda utilizado como desinfetante, anti-séptico e antibacteriano, como agente branqueador e conservador de produtos alimentares, nomeadamente frutos secos, e ainda na produção de bebidas alcoólicas e particularmente no fabrico do vinho.

Equipe: Sara, Taiana, Fernanda, Ada, Danilo, Matheus Paixão.
- E a poluição
Um óxido é um composto químico binário formado por átomos de oxigênio com
outros elementos. Os óxidos constituem um grande grupo na química, pois a
maioria dos elementos químicos formam os mesmos. Eles são gerados a partir
de diversas atividades humanas, principalmente a queima
de combustíveis fósseis. Vários destes óxidos têm impacto ambiental
importante sobre o meio ambiente:
Poluentes que são jogados diretamente no meio ambiente são conhecidos como
poluentes primários. Poluentes que são gerados a partir de alterações nos
poluentes primários, no próprio meio ambiente, são conhecidos como poluentes
secundários. Ordem crescente de impacto ambiental causado pelos diversos combustíveis...
álcool etílico < gasolina < querosene < óleo diesel
A grande desvantagem dos combustíveis derivados de petróleo é a presença de
compostos de enxofre, que quando queimam nos motores originam SO2, que tem
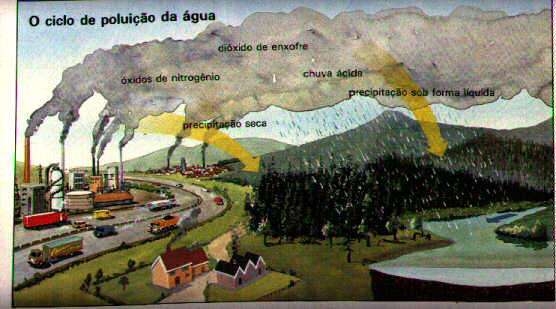
papel importante na formação da chuva ácida.
Óxidos do carbono, enxofre e nitrogênio e a chuva ácida
Normalmente a chuva tem pH ácido devido à presença do H2CO3. Como o CO2 presente
na atmosfera é um óxido ácido, em presença de água ocorre a seguinte reação:
CO2 + H2O => H2CO3
Isto faz com que normalmente a chuva tenha um pH de 5,6 em ambientes não poluídos.
Toda chuva com pH inferior a 5,6 é considerada ácida e tem impacto danoso sobre o meio ambiente:
- O solo pode se tornar ácido e ainda pode ocorrer danos nas folhas dos vegetais;
- Deterioração de monumentos e construções a partir da corrosão do mármore, ferro e outros materiais;
- Acidificação da água de lagos e rios, gerando condições prejudiciais à vida dos peixes.
A queima de combustíveis fósseis, como carvão e derivados de petróleo, gera a emissão dos
gases CO2, CO, SO2 e NO2. Os gases SO2 e NO2 podem originar chuva ácida interagindo na atmosfera
através das seguintes reações:
2 SO2 + O2 => 2 SO3
O SO2 e a chuva ácida
SO3 + H2O => H2SO4
N2 + O2 => 2 NO (no motor dos veículos)
O NO2 e a chuva ácida 2 NO + O2 => 2 NO2
2 NO2 + H2O => HNO3 + HNO2
A chuva também pode ser ácida em ausência de poluição quando ocorrem raios. As seguintes
reações podem ser desencadeadas:
A chuva também pode ser
ácida em ausência de N2 + O2 => 2 NO (provocada pelos raios)
poluição quando ocorrem 2 NO + O2 => 2 NO2
raios. As seguintes 2 NO2 + H2O => HNO3 + HNO2
reações podem ser
desencadeadas:
O N2O é um gás que não apresenta toxicidade e que foi utilizado como anestésico, também conhecido
como gás hilariante.
O ozônio
O NO2 pode reagir com o oxigênio do ar na baixa atmosfera gerando ozônio.
NO2 + O2 => NO + O3 (presença de luz solar)
O ozônio é importante na camada de proteção contra radiação ultravioleta na alta atmosfera.
No entanto, na baixa atmosfera, é considerado um poluente grave, podendo causar irritação dos
olhos e garganta e queimaduras nas folhas das plantas.
Os óxidos do carbono
A queima dos combustíveis no interior dos motores gera a emissão de CO2, CO e carbono particulado.
O CO2 (dióxido de carbono) contribui para o efeito estufa, que é o aumento da temperatura média do
planeta. Outros gases que contribuem para o efeito estufa são CFCs, CH4 e N2O. A grande preocupação
com relação ao aquecimento global é que ele pode fazer com que parte das gelo dos pólos se derreta,
ocasionando um elevamento no nível dos oceanos.
O CO (monóxido de carbono) é extremamente tóxico. Possui afinidade pela hemoglobina 250 vezes maior
que a do oxigênio. Se inalado, pode causar desde dor de cabeça e tontura até a morte.
O carbono particulado é a fuligem responsável pela coloração escura que sai dos veículos e chaminés,
pode causar irritação dos olhos e problemas respiratórios.
Inversão térmica
Normalmente, o ar da camada mais baixa da atmosfera é mais quente que as superiores. Sendo menos denso,
ele sobe, sendo substituído por ar mais frio das camadas superiores. Quando este ar quente sobe, arrasta
com ele os poluentes atmosféricos gerados pelos diversos tipos de atividade humana. Geralmente no
inverno, pode se formar uma camada de ar frio abaixo da camada de ar quente, é a inversão térmica.
Ficam aprisionados nesta camada de ar frio mais próxima do solo todos os poluentes gerados, fazendo com
que a qualidade do ar se torne ruim.
Smog
Esta expressão vem do inglês...
smoke (fumaça) + fog (neblina) = smog
Smog industrial é o típico da cidade de Londres (Inglaterra) e é constituído por fumaça, neblina, SO2,
H2SO4, fuligem e outros poluentes. Ocorre no inverno (inversão térmica).
Smog fotoquímico ocorre em dias quentes e secos. É formado por gases de escapamentos, principalmente NO2
e hidrocarbonetos. Na presença de luz solar ...
NO2 + O2 => NO + O3
NO + O2 => NO2 + ½ O2
1/2 O2 + O2 => O3
O smog fotoquímico tem a coloração castanha característica do NO2. Os catalisadores automotivos convertem
hidrocarbonetos e o NO2 em compostos não tóxicos, mas que contribuem para o efeito estufa.
CxHy (hidrocarboneto) + O2 => CO2 + H2O (catalisador)
2 NO2 + 2 CO => N2 + 2 CO2 (catalisador)
2 NO2 + 3 CO => N2O + 3 CO2 (catalisador)
ANEXOS:





Grupo: Lucas Caribé, Rafael Augusto, Larry, Victor.
Nenhum comentário:
Postar um comentário